Orbitale atomowe , które są funkcjami matematycznymi, opisują zachowanie falowe elektronów (lub par elektronów) w atomie. Orbitale atomowe mają różne kształty w zależności od rodzaju. Różne kształty orbitali atomowych opisują, że istnieje najwyższe lub zerowe prawdopodobieństwo znalezienia elektronu wokół jądra w niektórych kierunkach. Istnieją cztery typy orbitali, każdy o innym kształcie i oznaczony literami s, p, d i f. Orbitale s i p są brane pod uwagę, ponieważ są one najbardziej rozpowszechnione w chemii chemicznej i biologicznej. Jakiś s-orbitalna ma kuliste jądro w środku, a p-orbitalna ma kształt hantli i cztery z pięciu d orbitale mają kształt liścia koniczyny. Piąty orbital d ma kształt długiego hantla z pączkiem pośrodku. Orbitale atomu są zorganizowane w warstwy lub powłoki elektronowe.
Co to są orbitale atomowe?
Orbitale atomowe to trójwymiarowa przestrzeń w pobliżu jądra atomu, w której możliwość odkrycia elektronu jest maksymalna.
Atom, zgodnie z kwantowym modelem atomu, może mieć nieskończoną liczbę orbitali. Orbitale te można klasyfikować na podstawie ich rozmiaru, kształtu lub orientacji. Węższy orbital oznacza większe prawdopodobieństwo złapania elektronu blisko jądra. Funkcja fali orbitalnej jest często nazywana funkcją matematyczną używaną do wyrażania współrzędnych elektronu. Prawdopodobieństwo zlokalizowania elektronu jest reprezentowane przez kwadrat funkcji falowej orbity. Ta funkcja falowa pomaga również w tworzeniu diagramów powierzchni granicznych.
Funkcja fali orbitalnej
The kwantowy model atomu przewiduje, że atom może mieć ogromną różnorodność orbitali. Orbitale te można pogrupować według ich rozmiaru, geometrii lub nachylenia. Zmniejszony rozmiar orbity zwiększa prawdopodobieństwo otrzymania elektronu blisko jądra. Funkcja matematyczna używana do przedstawienia współrzędnych elektronu nazywa się funkcja fali orbitalnej . Prawdopodobieństwo odkrycia elektronu jest reprezentowane przez kwadrat funkcji falowej orbity.
Możemy również użyć tej funkcji falowej do tworzenia diagramów powierzchni granicznych. Możemy lepiej zrozumieć postać orbitali, korzystając z diagramów powierzchni granicznych o stałej gęstości prawdopodobieństwa dla różnych orbitali.
praca przy komputerze
Kształty orbitali atomowych
Kształty orbitali atomowych są różne. Oznacza to, że rozkłady prawdopodobieństwa elektronów, które opisują, otaczających jądro, są różne. Fakt, że elektrony na różnych orbitaliach prawdopodobnie znajdują się w różnych obszarach wokół jądra macierzystego i w związku z tym doświadczają jego przyciągania z różną siłą, jest jednym z powodów, dla których orbitale różnią się energią. Zadziwiające jest, że wszystkie orbitale w danej powłoce atomu wodoru mają tę samą energię, a jednocześnie mają różne formy. Wynika to z eliminacji różnych składek związanych z energią.
Ale gdy tylko pojawi się drugi elektron, degeneracja znika.
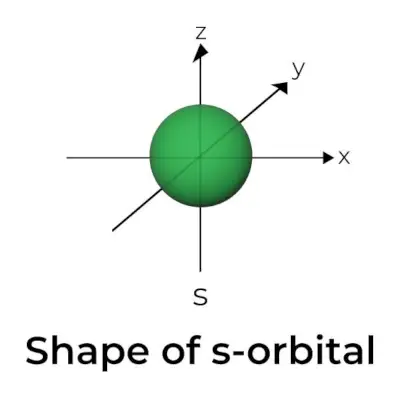
Kształt orbitalu s
- Schemat powierzchni granicznej orbity s przypomina kulę z jądrem w środku, co można przedstawić w dwóch wymiarach jako okrąg.
- s-orbitale są sferycznie symetryczne, co oznacza, że prawdopodobieństwo znalezienia elektronu w danej odległości jest takie samo we wszystkich kierunkach.
- Wykazano również, że rozmiar orbitalu s rośnie wraz ze wzrostem wartości pierwotnej liczby kwantowej (n); stąd 4s> 3s> 2s> 1s.
- Punkt węzłowy to miejsce, w którym nie ma szans na zlokalizowanie elektronu. Węzły dzielą się na dwa typy: węzły promieniowe i węzły kątowe. Odległość od jądra wyznaczają węzły promieniowe, natomiast orientację wyznaczają węzły kątowe.
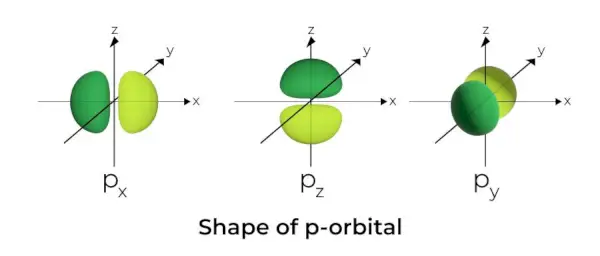
Kształt p-orbity
- Orbitale p są uformowane jak hantle.
- Węzeł orbitalny p znajduje się w centrum jądra.
- Ze względu na obecność trzech orbitali, orbital p może zajmować maksymalnie sześć elektronów.
- Każdy orbital p składa się z dwóch części zwanych płatami, które znajdują się po obu stronach płaszczyzny biegnącej przez jądro.
- Każdy orbital p ma części zwane płatami po obu stronach płaszczyzny biegnącej przez jądro. W płaszczyźnie, w której przecinają się dwa listki, prawdopodobieństwo znalezienia elektronu jest zerowe.
- Trzy orbitale są znane jako orbitale zdegenerowane, ponieważ mają ten sam rozmiar, kształt i energię.
- Jedyną różnicą między orbitalami jest orientacja płatów. Ponieważ płaty są zorientowane wzdłuż osi x, y lub z, nadano im nazwy 2pikseli, 2pyi 2pz. Do obliczenia liczby węzłów stosuje się wzór n –2.
- Podobnie jak w przypadku orbitali s, wielkość i energia orbitali p rosną wraz ze wzrostem pierwotnej liczby kwantowej (4p> 3p> 2p).
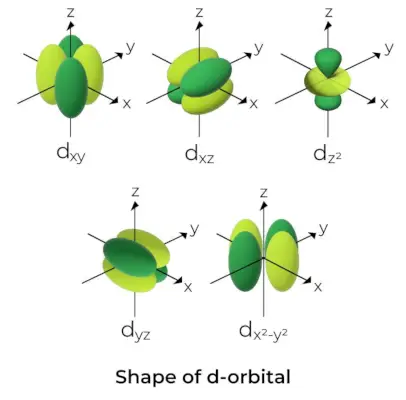
Kształt d-orbity
- W przypadku orbitali d liczbę kwantową orbity magnetycznej podaje się jako (-2, -1,0, 1,2). W rezultacie możemy stwierdzić, że istnieje pięć orbitali d.
- Orbitale te są oznaczone symbolami dxy, Dyz, Dxz, DX2-I2i Dz2.
- Formy pierwszych czterech orbitali d są do siebie podobne, czym różni się od dz2orbital, ale energia wszystkich pięciu orbitali d jest taka sama.
Kształt f-orbity
- Forma orbitalu f jest rozproszona. Ponieważ wartość l=3 dla orbitalu f, minimalna wartość pierwotnej liczby kwantowej n wynosi 4.
- Równoważne wartości ml dla orbitalu f to (-3, –2, –1, 0, +1, +2, +3).
- W rezultacie istnieje siedem orbitali f dla l = 3.

ubuntu, które polecenie
Zdegenerowane orbitale
Orbitale zdegenerowane to orbitale o tej samej energii. Orbitale te są różne (mogą być inaczej zorientowane w przestrzeni wokół jądro atomowe ), a mimo to mają tę samą energię. W obecności pola zewnętrznego degeneracja orbitalu p pozostaje nienaruszona; jednakże degenerację orbitali f i d można przerwać, przykładając do układu pole zewnętrzne (pole elektryczne lub magnetyczne).
Niewiele orbitali będzie miało wyższą energię, podczas gdy inne będą miały niższą energię. Degeneracja nie będzie już istnieć w systemie. Na przykład orbitale d składają się z pięciu zdegenerowanych orbitali, z których wszystkie mają tę samą energię.
Czytaj więcej:
- Teoria orbity molekularnej
- Wypełnienie orbity w atomie
- Hybrydyzacja
Często zadawane pytania dotyczące kształtów orbitali atomowych
Pytanie 1: Jak działają orbitale?
Odpowiedź:
Orbital atomowy to wyrażenie matematyczne wyrażające falowe zachowanie jednego elektronu lub pary elektronów w atomie w teorii atomowej i mechanice kwantowej. Każdy orbital zajmie maksymalnie dwa elektrony, każdy z własną wartością spinu.
w.next Java
Pytanie 2: Co to jest płaszczyzna węzłowa?
Odpowiedź:
Płaszczyzna, w której prawdopodobieństwo znalezienia elektronu jest znikome lub zerowe, nazywana jest płaszczyzną węzłową.
Pytanie 3: Ile jest orbitali?
lista niezmienna Java
Odpowiedź:
Ponieważ podpoziom s ma tylko jeden orbital, mogą w nim znajdować się tylko dwa elektrony. Ponieważ podpoziom p składa się z trzech orbitali, może w nim znajdować się maksymalnie sześć elektronów. Ponieważ podpoziom d składa się z 5 orbitali, może w nim znajdować się maksymalnie 10 elektronów. A każdy z czterech podpoziomów ma siedem orbitali, które mogą pomieścić maksymalnie 14 elektronów.
Pytanie 4: Które orbitale mają najwyższą energię?
Odpowiedź:
jsp
Orbital 1s ma najwięcej energii. Energia elektronu to ilość energii potrzebna do wydobycia go z bańki elektrycznej atomu.
Pytanie 5: Jaka jest różnica między powłoką a orbitalem?
Odpowiedź:
W atomie powłoka jest zbiorem podpowłok tej samej teorii liczb kwantowych, n. Każdy orbital ma dwa elektrony, a elektrony na tym samym orbicie mają tę samą definicję rozmiaru, wielkości momentu pędu i magnetycznej liczby kwantowej.
Pytanie 6: Co to jest wiązanie sigma i pi?
Odpowiedź:
Nakładanie się orbit atomowych tworzy wiązania sigma i pi. Wiązania Sigma powstają w wyniku nakładania się płatów orbitalnych atomów, podczas gdy wiązania Pi powstają, gdy jeden płat orbitalny atomu zachodzi na drugi.
