Koncepcja hybrydyzacja definiuje się jako proces łączenia dwóch orbitali atomowych w celu utworzenia nowego typu orbitali zhybrydyzowanych. To mieszanie zazwyczaj skutkuje utworzeniem orbitali hybrydowych o zupełnie różnych energiach, kształtach i tak dalej. Hybrydyzację przeprowadza się głównie za pomocą orbitali atomowych o tym samym poziomie energii. Jednak zarówno w pełni zapełnione, jak i w połowie zapełnione orbitale mogą brać udział w tym procesie, jeśli ich energie są równe. Koncepcja hybrydyzacji jest rozszerzeniem teorii wiązań walencyjnych, która pomaga nam zrozumieć powstawanie wiązań, energie wiązań i długości wiązań.
Co to jest hybrydyzacja?
Kiedy dwa orbitale atomowe łączą się, tworząc orbital hybrydowy w cząsteczce, energia orbitali poszczególnych atomów jest redystrybuowana, tworząc orbitale o równoważnej energii. Nazywa się to hybrydyzacją.
Orbitale atomowe o porównywalnych energiach są mieszane ze sobą podczas procesu hybrydyzacji, który najczęściej polega na połączeniu dwóch orbitali lub dwóch orbitali „p” lub zmieszaniu orbitalu „s” z orbitalem „p” oraz „s” orbital z orbitalem „d”.
Orbitale hybrydowe to nowe orbitale powstałe w wyniku tego procesu. Co ważniejsze, orbitale hybrydowe można wykorzystać do wyjaśnienia właściwości wiązań atomowych i geometrii molekularnej. Na przykład węgiel tworzy cztery pojedyncze wiązania, w których orbital s powłoki walencyjnej łączy się z trzema orbitalami p powłoki walencyjnej. Ta kombinacja generuje cztery równoważne sp3mieszaniny. Zostaną one ułożone w czworościenny wzór wokół węgla, który jest związany z czterema różnymi atomami.
najpiękniejszy uśmiech
Etapy określania rodzaju hybrydyzacji
Aby zrozumieć rodzaj hybrydyzacji w atomie lub jonie, należy przestrzegać następujących zasad.
- Najpierw określ całkowitą liczbę elektronów walencyjnych zawartych w atomie lub jonie.
- Następnie policz liczbę samotnych par przyłączonych do tego atomu lub jonu.
- Teraz liczbę wymaganych orbitali można obliczyć, dodając liczbę dupleksów lub oktetów i liczbę wolnych par elektronów.
- Należy zauważyć, że geometria orbitali w atomach lub jonach jest inna, gdy nie ma samotnej pary elektronów.
Cechy hybrydyzacji
- Hybrydyzacja zachodzi pomiędzy orbitalami atomowymi o równych energiach.
- Liczba utworzonych orbitali hybrydowych jest równa liczbie mieszających się orbitali atomowych.
- Nie jest wymagane, aby wszystkie orbitale w połowie wypełnione brały udział w hybrydyzacji. Mogą w nich uczestniczyć nawet orbitale całkowicie wypełnione, ale o nieco zróżnicowanej energii.
- Hybrydyzacja zachodzi tylko podczas tworzenia wiązania, a nie w pojedynczym atomie gazowym.
- Jeśli znana jest hybrydyzacja cząsteczki, można przewidzieć jej kształt.
- Większy płat orbitalu hybrydowego jest zawsze dodatni, podczas gdy mniejszy płat po przeciwnej stronie jest zawsze ujemny.
Typy hybrydyzacji
Hybrydyzację można sklasyfikować jako sp3, sp2, sp., sp3d, sp3D2lub sp3D3w oparciu o rodzaje orbitali biorących udział w mieszaniu.
sp Hybrydyzacja
Dzieje się tak, gdy jeden orbital s i jeden p w głównej powłoce atomu łączą się, tworząc dwa nowe równoważne orbitale. Nowo utworzone orbitale są znane jako orbitale zhybrydyzowane sp. Wytwarza cząsteczki liniowe pod kątem 180°. Polega to na połączeniu własnego orbitalu i jednego orbitalu „p” o równej energii w celu wytworzenia nowego orbitalu hybrydowego, znanego jako orbital zhybrydyzowany sp.
- Nazywa się to również hybrydyzacją diagonalną.
- Każdy zhybrydyzowany orbital sp zawiera taką samą liczbę znaków s i p.
- Wszystkie związki berylu, takie jak BeF2, Dobrze2i BeCl2, to przykłady.

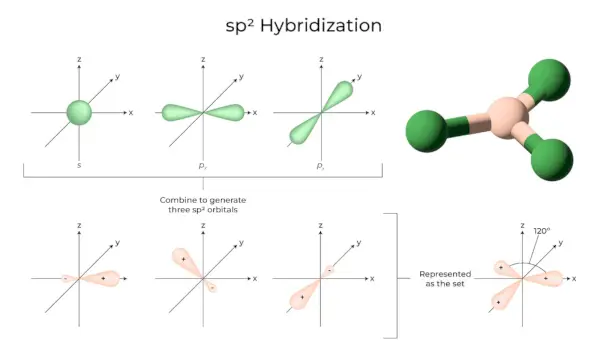
sp2Hybrydyzacja
Dzieje się tak, gdy jeden orbital s i dwa p powłoki tego samego atomu łączą się, tworząc trzy równoważne orbitale. Nowo utworzone orbitale są znane jako sp2orbitale hybrydowe. Nazywa się ją również hybrydyzacją trygonalną. Polega na połączeniu własnego orbitalu z dwoma orbitalami „p” o równej energii w celu stworzenia nowego orbitalu hybrydowego znanego jako sp2. Mieszanina symetrii trygonalnej orbitali s i p jest utrzymywana w temperaturze 120 stopni. Wszystkie trzy orbitale hybrydowe pozostają w tej samej płaszczyźnie i tworzą ze sobą kąt 120°.
- Każdy utworzony orbital hybrydowy ma 33,33% i 66,66% znaku „p”.
- Cząsteczki o trójkątnym, płaskim kształcie mają centralny atom, który jest połączony z trzema innymi atomami i ma sp2hybrydyzowane. Przykładami są związki boru.
sp3Hybrydyzacja
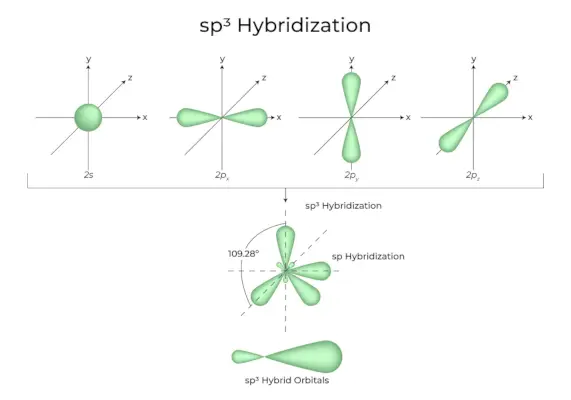
Kiedy jeden orbital „s” i trzy orbitale „p” z tej samej powłoki atomu łączą się, tworząc cztery nowe równoważne orbitale, hybrydyzacja jest znana jako hybrydyzacja tetraedryczna lub sp3. Nowo utworzone orbitale są znane jako sp3orbitale hybrydowe. Są one skierowane w cztery rogi czworościanu foremnego i tworzą między sobą kąt 109°28′.
- Sp3Orbitale hybrydowe tworzą kąt 109,28 stopnia.
- Każdy orbital hybrydowy ma 25% charakteru s i 75% charakteru p.
- Etan i metan to dwa przykłady.
sp3d Hybrydyzacja
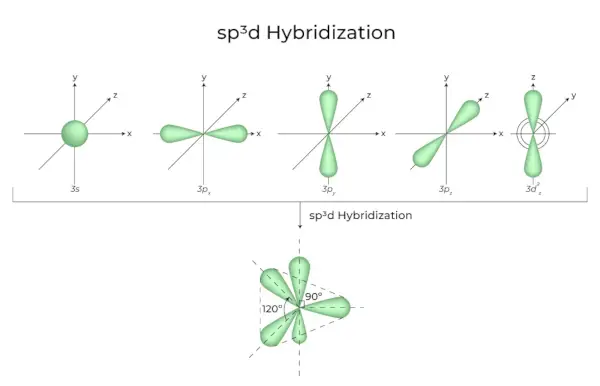
Mieszanie orbitali 1s, orbitali 3p i orbitali 1d daje w wyniku 5 zhybrydyzowanych orbitali sp3d o równej energii. Ich geometria jest dwupiramidalna trygonalna. Połączenie orbitali s, p i d skutkuje trygonalną symetrią bipiramidalną. Orbitale równikowe to trzy orbitale hybrydowe, zorientowane względem siebie pod kątem 120° i leżące w płaszczyźnie poziomej.
- Pozostałe dwa orbitale, zwane orbitalami osiowymi, znajdują się w płaszczyźnie pionowej pod kątem 90 stopni do orbitali równikowych.
- Na przykład hybrydyzacja w pięciochlorku fosforu (PCl5).
sp3D2 Hybrydyzacja
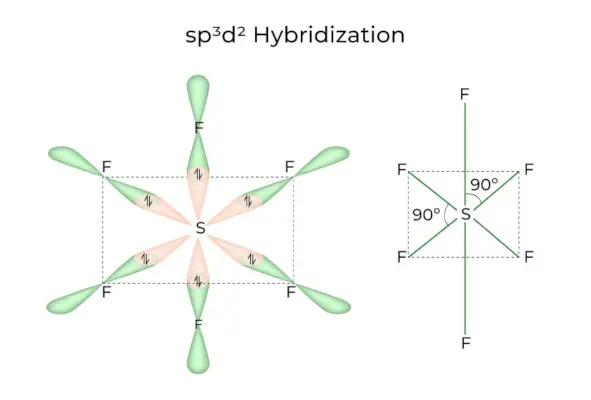
Kiedy orbitale 1s, 3p i 2d łączą się, tworząc 6 identycznych sp3D2orbitale hybrydowe, hybrydyzacja nazywana jest sp3D2Hybrydyzacja. Te siedem orbitali wskazuje narożniki ośmiościanu. Są one nachylone względem siebie pod kątem 90 stopni.
konwersja ciągu znaków na liczbę całkowitą
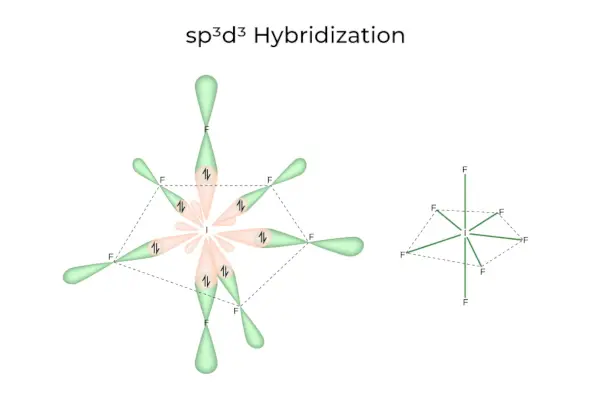
sp3D3Hybrydyzacja
Posiada orbitale 1s, 3p i 3d, które łączą się, tworząc 7 identycznych sp3D3orbitale hybrydowe. Te siedem orbitali wskazuje na narożniki pięciokątnej bipiramidy. np. JEŚLI6.
Kształty hybrydyzacji
- Liniowy: hybrydyzacja sp jest spowodowana oddziaływaniem grup dwuelektronowych; kąt orbity wynosi 180°. Planarny trygonalny: zaangażowane są trzy grupy elektronów, w wyniku czego powstaje sp2hybrydyzacja; orbitale są od siebie oddalone o 120°. Tetraedryczny: zaangażowane są cztery grupy elektronowe, w wyniku czego powstaje sp3hybrydyzacja; kąt orbity wynosi 109,5 °. Dwupiramid trygonalny: zaangażowanych jest pięć grup elektronowych, w wyniku czego powstaje sp3d hybrydyzacja; kąty orbity wynoszą 90° i 120°. Oktaedryczny: zaangażowanych jest sześć grup elektronowych, w wyniku czego powstaje sp3D2hybrydyzacja; orbitale są od siebie oddalone o 90°.
Często zadawane pytania na Hybrydyzacja
Pytanie 1: Który orbital hybrydowy, spośród sp, sp2 i sp3, jest bardziej elektroujemny?
Odpowiedź:
Procent znaku s w sp, sp2i sp3węgiel zhybrydyzowany wynosi odpowiednio 50%, 33,33% i 25%. Ze względu na kulisty kształt orbitalu s, jest on przyciągany równomiernie ze wszystkich kierunków przez jądro. W rezultacie orbital hybrydowy ze znakiem s będzie bliżej jądra, a zatem będzie bardziej elektroujemny. W rezultacie węgiel zhybrydyzowany sp jest najbardziej elektroujemny.
Pytanie 2: Czym są orbitale hybrydowe?
Odpowiedź:
pusta lista java
Orbitale hybrydowe powstają w wyniku połączenia standardowych orbitali atomowych i powstania nowych orbitali atomowych.
Pytanie 3: Jakich jest pięć kształtów hybrydyzacji?
podstawy selenu
Odpowiedź:
Liniowy, trygonalny planarny, czworościenny, trygonalny bipiramidalny i oktaedryczny to pięć podstawowych kształtów hybrydyzacji.
Pytanie 4: Dlaczego cząsteczka amidu wygląda jak sp3hybrydyzowany, ale jest sp2?
Odpowiedź:
Jeśli atom jest otoczony przez dwa lub więcej orbitali p lub ma samotną parę zdolną do wskoczenia na orbital p, ogólny proces hybrydyzacji ulegnie zmianie. W rezultacie w przypadku cząsteczki amidu samotna para wchodzi na orbital p, w wyniku czego powstają trzy sąsiednie równoległe orbitale p.
Pytanie 5: Jaka jest reguła Benta?
Odpowiedź:
Centralny atom połączony z wieloma grupami w cząsteczce będzie hybrydyzował, powodując, że orbitale o bardziej charakterze s będą skierowane w stronę grup elektrododatnich, a orbitale o większym charakterze p będą skierowane w stronę grup elektroujemnych.
