Zasada Aufbau jest podstawową metodą, która mówi nam, w jaki sposób elektrony są wypełnione orbitalem atomowym. Zgodnie z zasadą Aufbau, wypełnienie elektronami w stanie podstawowym atomu przebiega według podstawowego wzorca. Zasada ta mówi nam, że elektrony na orbicie atomowej dowolnych atomów są wypełniane w kolejności rosnącej według ich energii, a do znalezienia energii orbitalu atomowego stosuje się regułę n+l.
Zasada struktury
Kolejka priorytetów Java
W tym artykule dowiemy się szczegółowo o zasadzie Aufbau, cechach zasady Aufbau, jej wyjątkach i ograniczeniach.
Definicja zasady struktury
Mówi o tym zasada Aufbau
Elektrony na różnych orbitali są zapełniane w kolejności rosnącej ich energii, tzn. orbital o najniższej energii zostanie zapełniony jako pierwszy, a orbital o najwyższej energii zostanie zapełniony jako ostatni.
Słowo „Aufbau” w języku niemieckim oznacza „budowanie”. Tworzenie orbitali oznacza wypełnianie orbitali elektronami. Stwierdza, że elektrony w orbitali atomowych są wypełnione w kolejności rosnącej energii orbitalu atomowego. Natomiast energię orbitalu atomowego oblicza się za pomocą reguły n+l, która stwierdza, czy elektron z wyższą liczbą wartości n+l ma wyższą energię. W regule omówionej w poprzednim wierszu, N podaje główną liczbę kwantową i l informuje o liczbie kwantowej azymutu.
Jeśli dwa elektrony mają tę samą wartość n+l, to elektron o mniejszej wartości N ma mniejszą energię i jest napełniany jako pierwszy. Kolejność wypełniania elektronów na orbicie atomowej omówiono poniżej.
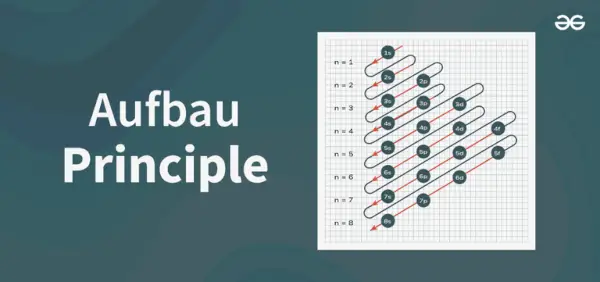
Struktura diagramu zasadniczego
Diagram zasad Aufbau to diagram przedstawiający kolejność wypełniania elektronów w atomie.
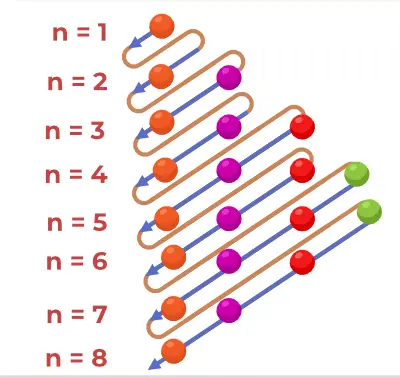
Struktura diagramu zasadniczego
Struktura zasady podstawowej
Wzór na zasadzie Aufbau to wzór określający kolejność, w jakiej elektrony są wypełniane na orbicie atomowej. Wzór orbity atomowej to
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p….
Struktura klasy zasad 11
Zasada Aufbau jest ważną zasadą chemii dla uczniów klasy 11. Zasada ta stwierdza, że:
Elektrony na orbicie atomowej atomu są wypełniane w kolejności rosnącej zgodnie z energią orbitalu atomowego obliczoną przy użyciu reguły (n+l).
Rysowanie schematu konstrukcji
Diagram Aufbau jest rysowany za pomocą kroków dodanych poniżej,
- Znajdź liczbę elektronów, które mają zostać wypełnione w atomach.
- Wiemy, że w atomie
- orbital s może pomieścić maksymalnie 2 elektrony.
- Orbital p może pomieścić maksymalnie 6 elektronów.
- Orbital d może pomieścić maksymalnie 10 elektronów.
- Orbital f może pomieścić maksymalnie 14 elektronów.
- Wypełnij pierwsze dwa elektrony na orbicie 1s.
- Następnie postępuj zgodnie z zasadą n+l i odpowiednio wypełnij elektrony.
Zasadnicze cechy zasady struktury
Różne cechy zasady Aufbau to:
- Energia orbitalu zależy od sumy wartości głównej liczby kwantowej (n) i sumy azymutalnej (I). Nazywa się to reguła (n + l). . Zgodnie z tą zasadą,
- W neutralnym, izolowanym atomie im niższa wartość (n + l) orbitalu, tym niższa jest jego energia. Jeśli jednak dwa różne typy orbitali mają tę samą wartość (n + l), wówczas orbitale o niższej wartości n mają mniejszą energię.
| Rodzaj orbity | Wartość n | Wartość l | Wartość n+l | Energia względna |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Najniższa energia |
| 2s | 2 | 0 multiplekser dwa do jednego | 2+0 = 2 | Wyższa energia niż orbital 1s |
| 14:00 3s | 2 odwrócony ciąg Java 3 | 1 0 | 2+1 = 3 3+0 = 3 | Orbitale 2p (n=2) mają niższą energię niż orbitale 3s(n=3). |
| 15:00 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | Orbitale 3p (n=3) mają niższą energię niż orbitale 4s(n=4). |
| 3d 16:00 | 3 przypadki testowe junit 4 | 2 1 | 3+2 = 5 4+1 = 5 | Orbitale 3d (n=3) mają niższą energię niż orbitale 4p(n=4). |
Z opisu podanego w tabeli wynika, że energie poszczególnych orbitali rosną wraz ze wzrostem liczby głównej liczby kwantowej.
- Zatem kolejność, w jakiej elektrony są wypełniane na orbicie atomowej atom Jest, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Konfiguracja elektroniczna z wykorzystaniem zasady Aufbau
The elektroniczna Konfiguracja użycie zasady Aufbau dla kilku elementów omówiono poniżej:
Konfiguracja elektronowa siarki
Liczba atomowa siarki wynosi 16, tj. ma 16 elektronów
Teraz, korzystając z zasady Aufbau, konfiguracja elektronowa siarki jest zapisana jako:
[S] = 1s 2 2s 2 14:00 6 3s 2 15:00 4
Konfiguracja elektronowa azotu
Liczba atomowa azotu wynosi 7, czyli ma 7 elektronów
Teraz, używając zasady Aufbau, konfiguracja elektronowa azotu jest zapisana jako:
[N] = 1s 2 2s 2 14:00 3
Wyjątki od zasady konstrukcyjnej
Istnieje kilka wyjątków od zasady Aufbau, którymi są chrom i miedź. Ich konfiguracja elektroniczna jest
punkt Java
Elektroniczna konfiguracja Chromu
Konfiguracja elektroniczna Chromu zgodnie z Zasadą Aufbau powinna być
- Cr(24): [Ar]3d 4 4s 2
Ale powyższa konfiguracja nie jest poprawna, ponieważ rzeczywista konfiguracja elektroniczna Chromu (Cr) jest następująca:
- Cr(24): [Ar]3d 5 4s 1
Powodem tej konfiguracji elektronicznej jest to, że w połowie wypełniony orbital d-atomowy jest bardziej stabilny niż orbital wypełniony zgodnie z zasadą Aufbau.
Elektroniczna konfiguracja miedzi
Konfiguracja elektroniczna miedzi zgodnie z zasadą Aufbau powinna być:
- Cu(29): [Ar]3d 9 4s 2
Powyższa konfiguracja nie jest poprawna, ponieważ rzeczywista konfiguracja elektroniczna miedzi (Cu) jest następująca:
- Cu(29): [Ar]3d 10 4s 1
Powodem tej konfiguracji elektronicznej jest to, że w pełni wypełniony orbital d-atomowy jest bardziej stabilny niż orbital wypełniony zgodnie z zasadą Aufbau.
Czytaj więcej
- Liczby kwantowe
- Kształt orbitali atomowych
- Struktura atomowa
Zasada struktury – często zadawane pytania
Co to jest zasada Aufbau w chemii?
Zasada Aufbau w chemii jest podstawową zasadą stosowaną do wypełniania elektronów na orbitali atomowych dowolnego atomu. Twierdzenie to mówi nam o kolejności, w jakiej elektrony są wypełniane na orbicie atomowej.
Kto dał zasadę Aufbau?
Prawo Aufbau zostało sformułowane przez słynnego duńskiego fizyka Nielsa Bohra w 1920 roku.
Co to jest zasada wykluczenia Pauliego?
Zasada wykluczenia Pauliego stwierdza, że w atomie nie ma dwóch elektronów o wszystkich czterech liczbach kwantowych T on taki sam. Przynajmniej jedna z liczb kwantowych jest różna dla wszystkich elektronów w atomie.
Co to jest reguła n+l?
Reguła n+l to reguła stwierdzająca, że energia orbitalu zależy od sumy głównej liczby kwantowej (n) i azymutalnej liczby kwantowej (l). reguła ta nazywana jest regułą (n+l).
Jakie są wyjątki od zasady Aufbau?
Wyjątkiem od zasady Aufbau są:
- Elektroniczna konfiguracja chromu Cr [24]
- Konfiguracja elektroniczna miedzi Cu[29]
