Zasada to związek chemiczny składający się z OH–jony i przyjmuje protony. Zasadami w chemii są te związki, które zmieniają kolor na czerwony lakmusowy i w reakcji z kwasem neutralizują reakcję, dając sól i wodę. Wartość pH bazy jest większa niż 7. Bazy mają gorzki smak i są śliskie w dotyku. Zasady rozpuszczalne w wodzie nazywane są zasadami. Przykładami zasad są tlenki metali, wodorotlenki metali itp. Mydło jest przykładem bazy, której używamy w życiu codziennym. W tym artykule poznamy szczegółowo definicję, właściwości i reakcje chemiczne zasad.

Definicja podstawy
Zasada jest definiowana jako związek chemiczny, którego wartość pH jest większa niż 7, przyjmuje proton, neutralizuje kwas i zmienia kolor czerwonego lakmusu na niebieski. Generalnie wyzwalają OH–jon podczas dysocjacji. Przykłady obejmują NaOH, NaHCO3,itp. Poniżej przedstawiono kilka ogólnych funkcji prezentowanych przez bazę:
- Mają gorzki smak
- Są śliskie w dotyku
- Zabarwiają czerwony lakmus na niebiesko
- Wyzwalają OH–jon po rozpuszczeniu w wodzie
- Przewodzą prąd w postaci roztworu
Zasady są jednymi z najważniejszych związków chemicznych stosowanych w życiu codziennym. Zasady stosowane są jako środki zobojętniające kwas, kontrolujące kwasowość oraz w pastach do zębów, aby zneutralizować działanie bakterii, które wytwarzają kwas w jamie ustnej i zapobiegają degradacji szkliwa i jamy ustnej. Stosowane są również jako proszek do pieczenia, soda oczyszczona i proszek do prania.
Baza Lewisa
Zasady Lewisa to związki posiadające parę elektronów, które mogą przekazać ją związkom, które mają niedobór par elektronów. Zasady Lewisa mają charakter nukleofilowy, tj. kochają jądra, co oznacza, że będą atakować dodatnio naładowane centrum swoimi parami elektronów. Przykłady zasady Lewisa obejmują amoniak, ponieważ w amoniaku (NH3) środkowy atom azotu ma 5 elektronów, z czego 3 są wykorzystywane do tworzenia wiązań z 3 atomami wodoru, a jedna para elektronów pozostaje z atomem N, tworząc w ten sposób NH3bazę Lewisa.
Baza Arrheniusa
Zgodnie z koncepcją Arrheniusa zasady to związki, które po rozpuszczeniu w wodzie uwalniają jony wodorotlenkowe i zwiększają stężenie jonów hydroksylowych w roztworze wodnym. Na przykład, gdy KOH zostanie rozpuszczony w wodzie, otrzyma OH–jonów i w ten sposób zwiększyć stężenie OH–w wodzie.
Baza Bronsteda
Bronsted Koncepcja Zasady jest zaawansowaną wersją Koncepcji Arrheniusa, która stwierdza, że zasady to związki akceptujące H+jon lub proton, tworząc sprzężony kwas. Na przykład kl–jest zasadą, która akceptuje H+tworząc HCl jako sprzężony kwas.
Rodzaje baz
Zasady można klasyfikować na podstawie kwasowości, stężenia i zdolności jonizacyjnej. Klasyfikacja jest opisana poniżej
Rodzaje zasad w zależności od kwasowości
Kwasowość zasady odnosi się do liczby wymiennych grup hydroksylowych obecnych w jednej cząsteczce zasady. Ze względu na kwasowość zasady dzieli się na trzy kategorie:
- Zasada jednokwasowa
- Zasada diakwasowa
- Zasada trikwasowa
Monokwasowy: Zasady monokwasowe to takie, które zawierają tylko jeden wymienny jon hydroksylowy i oddziałują tylko z jednym jonem wodorowym. Zasady jednokwasowe obejmują NaOH, KOH i inne.
główny Java
dikwasowy: Zasada dikwasowa to zasada z dwoma wymiennymi jonami hydroksylowymi, które oddziałują z dwoma jonami wodorowymi. Ca(OH)2, Mg(OH)2i inne zasady dwukwasowe są przykładami.
Trikwasowy: Zasada trikwasowa to rodzaj zasady składającej się z trzech wymiennych jonów hydroksylowych i trzech jonów wodorowych. Zasady trikwasowe obejmują Al (OH)3, Fe(OH)3, i inni.
Rodzaje zasad w zależności od ich stężenia w roztworze wodnym
Stężenie odnosi się do ilości zasady obecnej w roztworze wodnym. W zależności od stężenia w roztworze wodnym zasady dzieli się na dwie kategorie:
- Skoncentrowana baza
- Rozcieńczona baza
Skoncentrowana baza: Zasady stężone to takie, w których ilość zasady jest duża w porównaniu z rozpuszczalnikiem. Na przykład stężony roztwór NaOH.
Rozcieńczona baza: Tego typu zasady mają niższe stężenie zasady w roztworze wodnym. Rozcieńczanie to proces zmniejszania zawartości procentowej substancji rozpuszczonej poprzez dodanie większej ilości rozpuszczalnika. Na przykład rozcieńczyć NaOH, rozcieńczyć KOH i tak dalej.
Rodzaje zasad w zależności od stopnia jonizacji
Stopień jonizacji odnosi się do zdolności związku chemicznego do uwalniania jonów składowych po rozpuszczeniu w wodzie. W przypadku zasady stopień jonizacji odnosi się do zdolności zasady do uwalniania OH–jony po rozpuszczeniu w wodzie. W zależności od stopnia jonizacji zasady dzieli się na dwa typy:
- Mocna baza
- Słaba baza
Mocna baza: Mocne zasady to te zasady, które po rozpuszczeniu w wodzie całkowicie dysocjują i uwalniają jony OH-. Niektóre przykłady mocnych zasad obejmują NaOH, KOH itp.
Słaba baza: Zasady, które nie ulegają całkowitej dysocjacji i uwalniają jedynie ułamek jonu OH-, nazywane są słabą zasadą. Przykłady słabych zasad obejmują Al (OH)3,Cu(OH)2,itp.
Ucz się więcej, Mocne i słabe zasady
baza danych właściwości kwasów
Właściwości zasad
Ponieważ wiemy, że zasady to związki chemiczne, które zawierają jony OH-, zmieniają kolor na czerwony lakmusowy, itp. W tej sekcji dowiemy się o właściwościach fizycznych i chemicznych zasad wraz z krótką wiedzą na temat ich ogólnych właściwości.
Ogólne właściwości bazy
Ogólne właściwości baz są wymienione poniżej:
- Jon wodorotlenkowy (OH–) jest uwalniany do wody przez zasady. Im silniejsza staje się zasada, tym więcej jest uwalnianych jonów.
- Zasady reagują z kwasami tworząc sól. Kwasy reagują z zasadami. Ta reakcja zasady z kwasem nazywana jest reakcją zobojętniania.
- Zasady zmieniają kolor czerwonego lakmusu na niebieski.
- Strukturę białka można zmieniać za pomocą zasad. Bazy mają tę jakość, która sprawia, że są gładkie. Mydło to baza, która po zamoczeniu staje się niesamowicie śliska na skórze. Ze względu na zdolność modyfikowania struktury białek niektóre silne zasady są niezwykle niebezpieczne.
Właściwości fizyczne zasad
Bazy smakują Gorzkie: Bazy mają gorzki smak. Ze względu na gorycz mamy tylko kilka pokarmów zasadowych. Istnieje tylko kilka zasadowych materiałów spożywczych. Zasady należy smakować z większą ostrożnością niż kwasy.
Bazy są śliskie w dotyku: Po dotknięciu bazy są śliskie. Na przykład mydło.
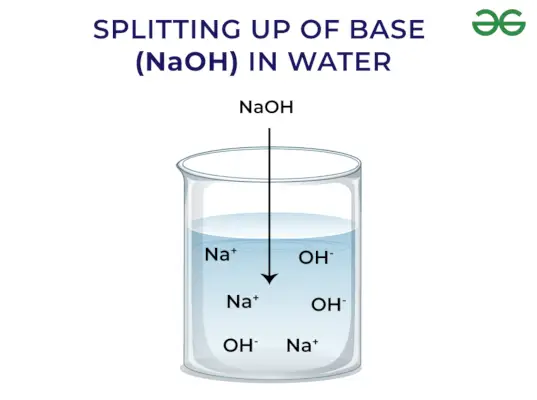
Zasady uwalniają OH – Jon: Zasady rozpuszczone w wodzie uwalniają jon hydroksylowy (OH–). W zależności od zdolności do uwalniania jonów hydroksylowych dzieli się je na mocne i słabe.
Zasady neutralizują Kwasy: Kiedy zasady reagują z kwasami, neutralizują się nawzajem i wytwarzają sól i wodę. Ta reakcja nazywa się Reakcja neutralizacji . Powiedzmy, że mamy kwas HY i zasadę „XOH”, wówczas utworzona sól będzie mieć postać „XY”. Równanie tej reakcji można zapisać jako HY + XOH → HOH + XY.
Zasady denaturacji białka: Denaturacja białka oznacza zniszczenie stabilności i struktury białka. To powoduje, że zasada jest szkodliwa dla człowieka, ponieważ ludzka skóra i włosy składają się z białka, a stosowane silne zasady, takie jak wodorotlenek sodu lub potasu, zwane także ługiem, wywierają szkodliwy wpływ na ludzką skórę.
Zasady zmieniają czerwony lakmus w niebieski: Kiedy zasady zetkną się z czerwonym lakmusem, zmieniają kolor na niebieski. Należy jednak zaznaczyć, że takiej zmiany nie da się zaobserwować próbując poddać reakcji suchą bazę z czerwonym papierkiem lakmusowym. Test papierka lakmusowego jest jedną z najstarszych metod badania bazy. Istnieją jednak również inne wskaźniki, takie jak fenoloftaleina
Zasady przewodzą prąd: Zasady w postaci roztworu zawierają mobilny jon OH-, dzięki czemu mogą przewodzić prąd.
Właściwości chemiczne zasad
- Reakcja zasady z metalami: Kiedy zasada (zasada) reaguje z metalem, powstaje sól i gazowy wodór.
Alkalia + Metal → Sól + Wodór
Przykłady:
- Kiedy wodorotlenek sodu oddziałuje z metalicznym glinem, powstaje glinian sodu i gazowy wodór.
2 NaOH + 2 Al + 2 H 2 O → 2NaAlO 2 + 2 godz 2
- Kiedy wodorotlenek sodu wchodzi w interakcję z metalicznym cynkiem, wytwarza gazowy wodór i cynkan sodu.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reakcja tlenków niemetali z zasadą: Sól i woda powstają w wyniku reakcji tlenków niemetali z zasadą.
Tlenek niemetalu + Zasada → Sól + Woda
Gdy wodorotlenek wapnia reaguje z dwutlenkiem węgla, powstaje węglan wapnia i woda.
Ca(OH) 2 + CO 2 → CaCO2 3 + H 2 O
- Reakcja zasady/zasady z solami amonowymi: Amoniak powstaje w wyniku reakcji zasad z solami amonowymi.
Alkalia + sól amonowa → Sól + Woda + Amoniak
Kiedy wodorotlenek wapnia reaguje z chlorkiem amonu, powstaje woda chlorku wapnia i amoniak.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
myflixr
Przykłady baz
Zasadami są zazwyczaj tlenek metalu, wodorotlenek metalu, wodorowęglan metalu, węglany metalu itp. Zobaczmy kilka przykładów zasad z ich zastosowaniem w formie tabelarycznej:
| Bazy | Aplikacje |
|---|---|
| Wodorotlenek potasu KO | Stosowany w bateriach alkalicznych |
| Wodorotlenek sodu NaOH | Stosowany do produkcji mydła i detergentów |
| Wodorotlenek magnezu Mg(OH) 2 ile tygodni w miesiącu | Stosowany jako leki zobojętniające kwas |
| Wodorowęglan sodu NaHCO3 3 | Używany jako soda oczyszczona |
| Węglan sodu Już 2 WSPÓŁ 3 | Używany jako soda oczyszczona |
| Amoniak NH 3 | Używany do produkcji środków czyszczących i produktów farmaceutycznych |
| Wodorotlenek wapnia Ca(OH) 2 | Stosowany w białym praniu wykonaj pętlę while w Javie |
Zastosowania baz
Istnieją różne przypadki użycia bazy, niektóre z nich to:
- Wodorotlenek sodu używany jest do produkcji mydła i papieru. Wodorotlenek sodu (NaOH) jest również wykorzystywany do produkcji sztucznego jedwabiu.
- Proszek wybielający wykonany jest z Ca(OH)2, powszechnie znane jako wapno gaszone lub wodorotlenek wapnia.
- Wodorotlenek wapnia służy do tworzenia suchych mieszanek malarskich i dekoracyjnych.
- Wodorotlenek magnezu, popularnie nazywany mlekiem magnezjowym, jest szeroko stosowanym środkiem przeczyszczającym. Jest również stosowany jako środek zobojętniający kwas, ponieważ zmniejsza nadmierną kwasowość w ludzkim żołądku.
- W laboratoriach wodorotlenek amonu jest odczynnikiem krytycznym.
- Wapno gaszone można wykorzystać do zneutralizowania nadmiernej kwasowości gleby.
Czytaj więcej
- Kwas, zasada i sól
- Siła kwasu
- Jonizacja kwasu i zasady
Często zadawane pytania dotyczące podstaw w chemii
1. Czym są bazy?
- Związki zasadowe mają gorzki smak.
- Konsystencja większości baz jest mydlana.
- Testowany na papierze lakmusowym w większości przypadków przekształca czerwony papierek lakmusowy w niebieski.
- W roztworze związki zasadowe również przewodzą prąd.
- Kiedy związki zasadowe rozpuszczają się w wodzie, uwalniają się jony OH-.
2. Jakie są funkcje baz?
W domu wykorzystujemy zasady jako środki czyszczące i zobojętniające kwas. Mydła, ług (stosowany w środkach do czyszczenia piekarników), mleko magnezjowe i Tums to przykłady popularnych domowych baz. Każdy z nich ma pH większe niż siedem, może zużywać wolny wodór i neutralizować kwasy.
3. Jaka jest najważniejsza różnica pomiędzy kwasem a zasadą?
Kwasy i zasady to dwa rodzaje żrących substancji chemicznych. Materiały kwasowe mają wartość pH od 0 do 7, podczas gdy zasady mają wartość pH od 7 do 14. Kwasy to jonowe substancje chemiczne, które rozkładają się w wodzie, tworząc jon wodorowy (H+), podczas gdy zasada dysocjuje, tworząc jon OH-.
4. Jakie są właściwości fizyczne zasad?
- Mają gorzki smak.
- Ich roztwory wodne mają właściwości mydlane.
- Zmieniają kolor papieru lakmusowego z czerwonego na niebieski.
- Ich roztwory wodne przewodzą prąd elektryczny.
- Wraz z uwolnieniem gazowego wodoru zasady reagują z metalami, tworząc sól.
5. Co się stanie, gdy wodorotlenek wapnia zareaguje z chlorkiem amonu?
Kiedy wodorotlenek wapnia reaguje z chlorkiem amonu, powstaje woda chlorku wapnia i amoniak.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Co się stanie, gdy wodorotlenek sodu zareaguje z cynkiem metalicznym?
Kiedy wodorotlenek sodu wchodzi w interakcję z metalicznym cynkiem, wytwarza gazowy wodór i cynkan sodu.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Co to jest zasada Lewisa?
Zasada Lewisa to związki, które oddają parę elektronów związkowi z niedoborem elektronów. Przykład obejmuje NH3.
8. Z czego wykonane są Podstawy?
Zasady zazwyczaj składają się z OH–jon. Oprócz tlenków metali, zasadami są także węglany i wodorowęglany.
9. Co to są zasady?
Zasady rozpuszczalne w wodzie nazywane są zasadami. Przykładem jest wodorotlenek sodu NaOH.
10. Czym jest silna baza i słaba baza?
Zasady, które dysocjują całkowicie, dając OH–jony po rozpuszczeniu w wodzie nazywane są mocną zasadą. Przykłady obejmują NaOH. Słabe zasady to te, które nie dysocjują całkowicie, uwalniając OH–jon nazywany jest słabą zasadą. Przykłady słabych zasad obejmują wodorotlenek amonu.
